PROUCTS LIST
超高速原子力顯微鏡HS-AFM+質(zhì)量光度計觀察粘連蛋白介導(dǎo)DNA環(huán)擠出
超高速原子力顯微鏡HS-AFM+質(zhì)量光度計觀察粘連蛋白介導(dǎo)DNA環(huán)擠出
超高速視頻級原子力顯微鏡(High-Speed Atomic Force Microscope,HS-AFM)由日本 Kanazawa 大學(xué) Prof. Ando 教授團隊研發(fā),日本RIBM公司(生體分子計測研究所株式會社,Research Institute of Biomolecule Metrology Co., Ltd)商業(yè)化的產(chǎn)品,可以達到視頻級成像的商業(yè)化原子力顯微鏡。HS-AFM突破了傳統(tǒng)原子力顯微鏡“掃描成像速慢"的限制,能夠在液體環(huán)境下超快速動態(tài)成像,分辨率為納米水平。樣品無需特殊固定,不影響生物分子的活性,尤其適用于生物大分子互作動態(tài)觀測。超高速視頻級原子力顯微鏡HS-AFM主要有兩種型號,SS-NEX樣品掃描(Sample-Scanning HS-AFM)以及PS-NEX探針掃描(Probe-Scanning HS-AFM)。推出至今,已有150多位用戶,發(fā)表 SCI 文章 300 余篇,包括Science, Nature, Cell 等雜志。
相較于目前市場上的原子力顯微鏡成像設(shè)備,HS-AFM突破了 “掃描成像速慢"的限制,掃描速度高可達 20 frame/s,并且有 4 種掃描臺可供選擇。樣品無需特殊固定染色,不影響生物分子的活性,尤其適用于生物大分子互作動態(tài)觀測。液體環(huán)境下直接檢測,超快速動態(tài)成像,分辨率為納米水平。探針小,適用于生物樣品;懸臂探針共振頻率高,彈簧系數(shù)小,避免了對生物樣品等的損傷。懸臂探針可自動漂移校準(zhǔn),適用于長時間觀測。采用動態(tài)PID控制,高速掃描時仍可獲得清晰的圖像。XY軸分辨率2nm;Z軸分辨率0.5nm。
HS-AFM不僅擁有超高掃描速率與原子級別分辨率,而且具有操作的簡易性,使得對單分子動態(tài)過程的捕捉變得十分方便,為科研工作者研究和理解生物物理、生物化學(xué)、分子生物學(xué)、病毒學(xué)以及生物醫(yī)學(xué)等領(lǐng)域的單分子動態(tài)過程提供了一款強大的工具。全新的HS-AFM采用了新的高頻微懸臂架構(gòu),更低噪音、更高穩(wěn)定性的控制器,高速掃描器,緩沖防震設(shè)計,主動阻尼,動態(tài)PID,驅(qū)動算法優(yōu)化,多種前沿技術(shù),可以實現(xiàn)在超高速下獲取高分辨的生物樣品信息。新系統(tǒng)整合了基于工作流程的操作軟件,直觀的用戶界面與流程化、自動化的設(shè)置使得研究人員可以專注于實驗設(shè)計,不需要復(fù)雜的操作和條件設(shè)置,快速獲取數(shù)據(jù),加速研究的產(chǎn)出。

基因組DNA折疊形成環(huán)狀以及拓?fù)潢P(guān)聯(lián)結(jié)構(gòu)域(Topologically associating domains,TADs),從而組成了基因組復(fù)雜的三維結(jié)構(gòu),這些三維結(jié)構(gòu)具有重要的結(jié)構(gòu)和調(diào)控作用。先前的研究已經(jīng)逐漸揭示出基因組結(jié)構(gòu)是由染色體結(jié)構(gòu)維持SMC(Structural maintenance of chromosomes)蛋白復(fù)合物所介導(dǎo)的環(huán)擠出(DNA loop extrusion)過程形成的(圖1)。單分子層面的研究表明SMC蛋白復(fù)合體和Cohesin蛋白的確能夠?qū)NA擠壓形成環(huán)狀。因此,關(guān)于基因組的三維結(jié)構(gòu)形成研究者們提出了“環(huán)擠出假說",認(rèn)為染色體結(jié)構(gòu)維持的SMC復(fù)合物組織就基因組的拓?fù)浣Y(jié)構(gòu),并通過環(huán)擠出來實現(xiàn)這一功能。但是這一過程的具體細(xì)節(jié)是如何進行的還不得而知。
奧地利維也納生物中心 (VBC)分子病理學(xué)研究所Jan-Michael Peters研究組發(fā)現(xiàn)粘連蛋白通過“擺動和鉗夾"機制介導(dǎo) DNA 環(huán)擠出。2021年10月7日出版的《細(xì)胞》雜志發(fā)表了這一成果。作者分析了人類粘連蛋白-NIPBL 復(fù)合物如何介導(dǎo)環(huán)擠出,并使間期細(xì)胞中的染色質(zhì)折疊。 他們已經(jīng)確定了環(huán)擠出所需的 DNA 結(jié)合位點和大規(guī)模構(gòu)象變化,并確定了這些是如何協(xié)調(diào)的。他們的結(jié)果表明 DNA 通過自發(fā)的 50 nm 擺動的粘連蛋白鉸鏈轉(zhuǎn)移,將 DNA 交給 SMC3 的 ATPase 頭部,在那里結(jié)合 ATP,然后DNA 被 NIPBL 夾住。
在這個過程中,NIPBL 從鉸鏈“跳躍"到 SMC3 頭部,從而可能將自發(fā)鉸鏈擺動與 ATP 依賴性 DNA 夾緊結(jié)合起來。 這些結(jié)果揭示了粘連蛋白-NIPBL 和可能的其他染色體結(jié)構(gòu)維持 (SMC)復(fù)合物如何介導(dǎo)環(huán)擠出的機械原理。
該實驗過程通過借助日本RIBM公司研發(fā)的超高速視頻原子力顯微鏡HS-AFM來完成,HS-AFM突破了傳統(tǒng)原子力顯微鏡“掃描成像速慢"的限制,能夠?qū)崿F(xiàn)在液體環(huán)境下超快速動態(tài)成像,分辨率為納米水平。待測樣品無需特殊固定,不影響生物分子的活性,尤其適用于生物大分子互作動態(tài)觀測。
目前,一些體外的生化重構(gòu)實驗一定程度上已經(jīng)證實了環(huán)擠出假說,這些結(jié)果證明SMC蛋白與Cohesin蛋白會以2.1kb/s的速度擠壓DNA,并且這一過程依賴于ATP酶活性(圖2)。但限于實驗分辨率等問題,環(huán)擠出的過程是如何實現(xiàn)的具體細(xì)節(jié)還不得而知。
DNA環(huán)擠出過程中具體的構(gòu)象變化是如何發(fā)生的呢?為了揭開這一過程的全貌,作者們應(yīng)用了高速原子力顯微鏡(High-speed atomic force microscopy,HS-AFM)對Cohesin進行了實時成像。
在ATP存在的情況下的,Cohesin三聚體復(fù)合物中會在環(huán)狀、桿狀以及彎曲狀構(gòu)象之間的變化。作者們發(fā)現(xiàn)DNA是通過Cohesin蛋白鉸鏈的彎曲進而易位的,這樣將DNA轉(zhuǎn)移到SMC3的ATP酶活性頭部,在該位置與ATP結(jié)合,DNA被NIPBL夾住。在此過程中NIPBL從鉸鏈向SMC3頭部移動,引發(fā)鉸鏈區(qū)域的自發(fā)擺動以及ATP依賴的DNA結(jié)合,從而形成一個循環(huán),使得DNA從鉸鏈延伸到SMC3的頭部,在此循環(huán)周期的末尾,DNA片段可以轉(zhuǎn)移到SMC1的頭部。由此,作者們提出了DNA環(huán)擠出的“擺-夾"“Swing and clamp"模型,這類似于抓娃娃機的小爪子,可以將通過鉸鏈的彎曲伸出機械手“抓住"DNA,然后上提,從而通過一次次循環(huán)促使DNA逐步環(huán)擠出。
結(jié)果:
(1):人黏連蛋白由四個亞基組成:SMC1,SMC3,Scc1和STAG1。SMC1和SMC3通過它們的鉸鏈結(jié)構(gòu)域異二聚化。SMC1-SMC3鉸鏈異二聚體與STAG1的“ U"的底部直接接觸,DNA首先由NIPBL和STAG1募集到處于SMC1和SMC3頭部結(jié)構(gòu)域分離狀態(tài)的黏連蛋白,ATP結(jié)合后,Scc1連接SMC1和SMC3的ATPase頭部結(jié)構(gòu)域形成環(huán),并將DNA捕獲在SMC隔室內(nèi)。然后,NIPBL和STAG1包裹在DNA周圍,形成中ZHONG央通道并進一步包裹DNA。
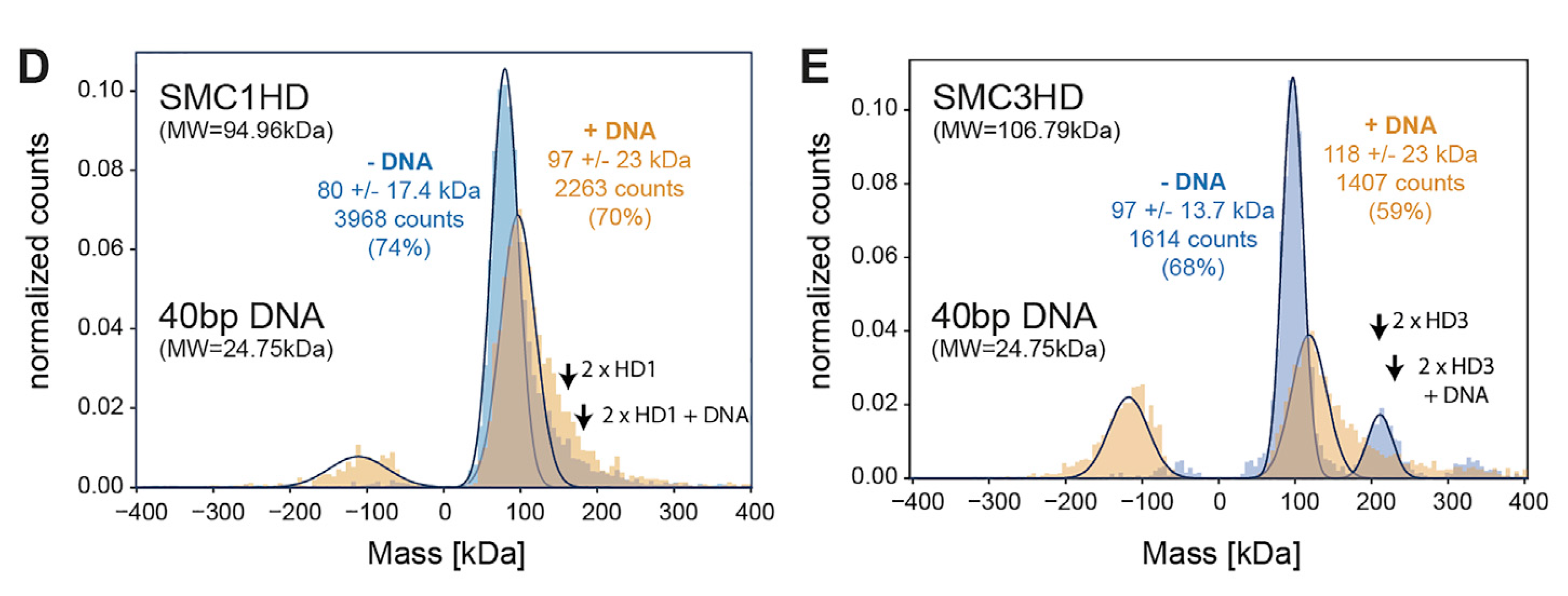
(2):通過TwoMP質(zhì)量光度法(單分子質(zhì)量光度計分析系統(tǒng))證實了SMC1和SMC3頭部結(jié)構(gòu)域(SMC1HD、SMC3HD)可以各自結(jié)合單個DNA分子作為單體:在存在ATP的前提下,對SMC1HD和SMC3HD含和不含40堿基對(bp)雙鏈(ds)DNA進行質(zhì)量光度分析,負(fù)質(zhì)量對應(yīng)于蛋白質(zhì)-DNA復(fù)合物在兩幀之間從表面解離的事件。
(3):冷凍電鏡Cryo-EM在不同的構(gòu)象中觀察到了黏連蛋白,但尚不清楚哪些在天然條件下存在,以及黏連蛋白如何從一種構(gòu)象變化到另一種構(gòu)象。因此,作者通過超高速視頻級原子力顯微鏡HS-AFM實時成像黏連蛋白。為了確定哪些亞基和結(jié)構(gòu)域可以通過HS-AFM可視化,作者分析了在含有SMC1、SMC3和SCC1的三聚體及結(jié)合到NIPBL(N)的三聚體,以及含有SMC1、SMC3和SCC1和STAG1(S)的四聚體及結(jié)合到NIPBL的四聚體,圖F中顯示了對應(yīng)于鉸鏈(hi)、頭部(he)、NIPBL(N)和STAG1(S)的密度。

(4):隨后通過質(zhì)量光度法測定的二聚體(SMC1、SMC3)和三聚體(SMC1、SMC3和SCC1)的質(zhì)量分布,可以證實這些復(fù)合體中含有SCC1,并且二聚體(286 kDa)和三聚體(399 kDa)的理論質(zhì)量與測量值非常一致(圖G、H)。質(zhì)量光度法(Mass Photometry)是一種革命性的分子分析新方法。它能夠準(zhǔn)確測量溶液中天然狀態(tài)下的單個分子的質(zhì)量數(shù),無需標(biāo)記,為生物分析和生物分子功能研究開辟了新的途徑。其原理是:粒子散射的光信號與粒子的體積和折射率成線性關(guān)系。由于生物分子的光學(xué)性質(zhì)和密度僅有百分之幾的差別,所以散射信號也就與分子的質(zhì)量成正比,因此可以用光稱量單個分子。散射信號與質(zhì)量的相關(guān)性適用于各種生物分子(例如糖蛋白、核酸和/或脂質(zhì)),這使得質(zhì)量光度法成為溶液中生物分子的通用分析工具。

(5):在ATP存在下,(SMC1、SMC3和SCC1)三聚體復(fù)合物方式上在環(huán)狀(rings)、棒狀(rods)和扭曲(bent)構(gòu)象之間交替出現(xiàn)(圖I)。在環(huán)形復(fù)合體中,卷曲的線圈被拉伸但彼此分開,而頭部結(jié)構(gòu)域要么相互接觸,代表ATP接合狀態(tài);要么頭部結(jié)構(gòu)域脫離,代表ATP非接合狀態(tài)。在桿狀復(fù)合體中,頭部結(jié)構(gòu)域脫離,線圈對齊;在許多情況下,相互扭曲(圖I),在這種狀態(tài)下,鉸鏈有時會短暫打開。

(6):(SMC1、SMC3和SCC1)三聚體復(fù)合物在接合和脫離狀態(tài)之間振蕩,在后一種構(gòu)造中,可以對齊和彎曲其線圈(圖K,head movement,coil alignment);當(dāng)STAG1和NIPBL與三聚體結(jié)合時,也觀察到類似的變化;當(dāng)線圈折疊成彎曲是不對稱狀態(tài)時,鉸鏈靠近一個頭部,但不靠近另一個頭部(圖K,hinge bending,鉸鏈彎曲)。
討論:
由染色體結(jié)構(gòu)維持SMC蛋白復(fù)合物所介導(dǎo)的DNA環(huán)的擠出過程仍然是一個迷,這一過程被認(rèn)為具有重要的結(jié)構(gòu)和調(diào)控功能。作者通過超高速視頻級原子力顯微鏡HS-AFM實時成像技術(shù)首SHOU次深入了解了人類粘連蛋白-NIPBL復(fù)合物易位DNA以介導(dǎo)DNA環(huán)擠出的機制原理,并可能對理解其他SMC復(fù)合物如何發(fā)揮這一功能具有更廣泛的意義。
作者通過超高速視頻級原子力顯微鏡實時成像,實現(xiàn)了對Cohesin促使的DNA環(huán)擠出過程的全紀(jì)錄,從而能夠?qū)NA從一個結(jié)合位點帶到另一個結(jié)合位點,揭開了SMC復(fù)合體進行基因組的折疊的以及促進復(fù)雜基因組三維拓?fù)浣Y(jié)構(gòu)形成的機制。通過質(zhì)量光度法測定的二聚體(SMC1、SMC3)和三聚體(SMC1、SMC3和SCC1)的質(zhì)量分布。
參考文獻:
Benedikt W. Bauer, et al. Cohesin mediates DNA loop extrusion by a“swing and clamp"mechanism. Cell 184, 5448–5464, October 14, 2021.
新品推薦——日本RIBM公司研發(fā)的超高速視頻原子力顯微鏡HS-AFM來到中國
為了更好地服務(wù)國內(nèi)客戶,北京佰司特科技有限責(zé)任公司將這款超高速視頻級原子力顯微鏡引進中國,如果您有科研上的需要,歡迎致電聯(lián)系我們!
北京佰司特科技有限責(zé)任公司
類器官串聯(lián)芯片培養(yǎng)系統(tǒng)—HUMIMIC;類器官灌流式培養(yǎng)和代謝監(jiān)測系統(tǒng)—IMOLA;
蛋白穩(wěn)定性分析儀—PSA-16;單分子穩(wěn)定性分析儀(磁鑷力譜測量儀)—HiMT;單分子質(zhì)量光度計—TwoMP;超高速視頻級原子力顯微鏡—HS-AFM;微流控擴散測量儀—Fluidity One-M;
微納加工點印儀—NLP2000/DPN5000;臺式原子力顯微鏡—ACST-AFM;全自動半導(dǎo)體式細(xì)胞計數(shù)儀—SOL COUNT;農(nóng)藥殘留定量檢測儀—BST-100;

